
Es aquella parte de la química que estudia los compuestos qué contienen carbono. También llamada química orgánica veamos porque:
Su nombre se debe a que inicialmente estudiaba todas las sustancias obtenidas como producto de las transformaciones que se realizaban en organismos animales y vegetales, .esto no es del todo cierto, debido a que muchas sustancias orgánicas se obtienen todavía de los seres vivos y no se han logrado sintetizar en el laboratorio, sin embargo, en contraposición se han conseguido fabricar materiales orgánicos que no produce la naturaleza tales como nylon, el PVC, muchos colorantes que se utilizan en la industria y centenares de drogas de aplicación farmacéutica. |
El conocimiento y utilización de los compuestos orgánicos se confunde con el origen mismo del ser humano. En la Biblia existen múltiples referencias, desde la época de Noé, a la utilización del vino, del vinagre, de los colorantes de los venenos, remedios, pócimas, ungüentos, perfumes y esencias, que están constituidos por sustancias orgánicas.
Los antiguos egipcios utilizaban la médula de la planta de papiro para escribir sus jeroglíficos.
Los colorantes de origen natural eran conocidos y manejados por el hombre desde tiempos antiguos, como la tintura azul de índigo, obtenida de la especie indigofera, utilizada por los egipcios para colorear las vendas de sus momias, la tintura de cochinilla (ácido carmínico), que aún se extrae de la hembrea de la cochinilla, insecto que habita en los cactus de Centroamérica, tintura muy apreciada por los grandes maestros de la pintura renacentista. Los fenicios obtenían el colorante púrpura real (púrpura de Tiro), extraída de un molusco del mediterráneo.
Se fabricaban también extractos de plantas para causar la muerte. Famoso es el caso del filósofo griego Sócrates que en 399 ac. Fue condenado a beber cicuta, Extracto de una planta que contiene la cicutina; alcaloide muy toxico.
Pero por fortuna también se extraían sustancias benéficas que servían para recuperar la salud. El mismo Hipócrates (hacia 460 a 377a.C) considerado el padre de la medicina, establece referencias de sustancias curativas de origen natural: en los siglos XVI y XVII tuvo gran desarrollo la iatroquímica o química médica creada por Paracelso. Existen referencias del conocimiento que tenían los chinos de plantas antimaláricas en épocas muy antiguas.
En el siglo V ac. Conocían los griegos el proceso de destilación, desarrollado mucho tiempo después (Siglo VII dc.) por los árabes, que les permitió elaborar alcohol etílico, y ácido acético.
En la época actual, la química orgánica lograra sintetizar gran variedad de compuestos naturales o artificiales, para usos en la industria, en la medicina en el transporte, hasta el punto que se han conseguido entre otras, la síntesis de sustancias tales como la insulina, hormona secretada por el páncreas que regula el metabolismo de los azucares, utilizada en el tratamiento de la diabetes. Se han sintetizado además numerosos materiales plástico para diferentes usos y la primera vacuna sintética, contra la malaria, elaborada por el médico Colombiano Manuel Elkin Patarroyo y su equipo de colaboradores. Parte muy importante de la investigación se dirige hoy en día hacia la síntesis de nuevos materiales con propiedades específicas para solucionar problemas concretos y mejorar la calidad de vida de la humanidad.
Los antiguos egipcios utilizaban la médula de la planta de papiro para escribir sus jeroglíficos.
Los colorantes de origen natural eran conocidos y manejados por el hombre desde tiempos antiguos, como la tintura azul de índigo, obtenida de la especie indigofera, utilizada por los egipcios para colorear las vendas de sus momias, la tintura de cochinilla (ácido carmínico), que aún se extrae de la hembrea de la cochinilla, insecto que habita en los cactus de Centroamérica, tintura muy apreciada por los grandes maestros de la pintura renacentista. Los fenicios obtenían el colorante púrpura real (púrpura de Tiro), extraída de un molusco del mediterráneo.
Se fabricaban también extractos de plantas para causar la muerte. Famoso es el caso del filósofo griego Sócrates que en 399 ac. Fue condenado a beber cicuta, Extracto de una planta que contiene la cicutina; alcaloide muy toxico.
Pero por fortuna también se extraían sustancias benéficas que servían para recuperar la salud. El mismo Hipócrates (hacia 460 a 377a.C) considerado el padre de la medicina, establece referencias de sustancias curativas de origen natural: en los siglos XVI y XVII tuvo gran desarrollo la iatroquímica o química médica creada por Paracelso. Existen referencias del conocimiento que tenían los chinos de plantas antimaláricas en épocas muy antiguas.
En el siglo V ac. Conocían los griegos el proceso de destilación, desarrollado mucho tiempo después (Siglo VII dc.) por los árabes, que les permitió elaborar alcohol etílico, y ácido acético.
En la época actual, la química orgánica lograra sintetizar gran variedad de compuestos naturales o artificiales, para usos en la industria, en la medicina en el transporte, hasta el punto que se han conseguido entre otras, la síntesis de sustancias tales como la insulina, hormona secretada por el páncreas que regula el metabolismo de los azucares, utilizada en el tratamiento de la diabetes. Se han sintetizado además numerosos materiales plástico para diferentes usos y la primera vacuna sintética, contra la malaria, elaborada por el médico Colombiano Manuel Elkin Patarroyo y su equipo de colaboradores. Parte muy importante de la investigación se dirige hoy en día hacia la síntesis de nuevos materiales con propiedades específicas para solucionar problemas concretos y mejorar la calidad de vida de la humanidad.
| Compuestos orgánicos | Compuestos inorgánicos |
|---|---|
| Son combustibles | Muy pocos son combustibles |
| Son solubles en sustancias orgánicas y poco solubles en agua | Son insolubles en sustancias orgánicas y solubles en agua |
| Forman enlaces covalentes | Forman enlaces iónicos |
| actualmente se conocen alrededor de2,000,000 | Solo forman 60,000 compuestos |
| Presentan puntos de fusión y ebullición bajos | Presentan puntos de fusión y ebullición altos |
| Formados principalmente por carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N) entre otros pocos elementos | Formados por la mayoría de los elementos químicos |
| Gracias a sus características químicas, el átomo de carbono presenta siempre cuatro enlaces (puede estar unido a otros cuatro elementos) veamos: Cada uno de los guiones que aparecen en la formula entre el átomo de carbono y los átomos de hidrogeno representan un enlace químico. |
Taller de lectura 1:
- ¿Qué estudia la química orgánica?
- ¿A qué se debe el nombre de química orgánica?
- ¿Cuáles son las aplicaciones de la química en la vida del hombre?
- ¿A qué se refiere el término industria farmacéutica?
- ¿Qué nombre recibía la planta con la cual los egipcios escribían los jeroglíficos?
- ¿Qué usos tenía la tintura azul de índigo, la de cochinilla y la púrpura de tiro?
- ¿Qué es la cicuta?
- ¿A qué se refiere el término iatroquímica y quien lo empleó?
- ¿Qué compuestos orgánicos se pueden obtener mediante la destilación y su uso mas frecuente por el hombre?
- ¿Qué función cumple la insulina en el organismo humano?
- ¿En qué sustancias son solubles los compuestos orgánicos?
- El punto de ebullición es la temperatura a la cual una sustancia liquida pasa a gas (se evapora). ¿Cómo es el punto de ebullición en los compuestos orgánicos?
- ¿Qué elementos forman a los compuestos orgánicos. nómbrelos ?
- ¿Qué elementos forman a los compuestos inorgánicos? Escriba cinco ejemplos
- ¿Cuántos enlaces presenta un átomo de carbono y como se representan en una fórmula?
- ¿Qué diferencia hay entre una formula estructural; una semicondensada y una condensada?
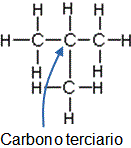
Clases de átomos de carbono
En el siguiente mapa conceptual se hace un resumen de la clasificación de los compuestos orgánicos, en cuanto al tipo de cadenas de carbono que se presentan (cadenas abiertas y cadenas cerradas)
Veamos algunos ejemplos:- ¿Cómo pueden ser las clases de átomos de carbono según sus enlaces?
- ¿Cuándo un carbono es primario, secundario, terciario o cuaternario?
- Dé un ejemplo de cada uno
- ¿Cuáles pueden ser las dos grandes clases de compuestos orgánicos?
- ¿Qué diferencia hay entre un compuesto cíclico y uno acíclico?
- ¿Qué tipo de enlaces entre átomos de carbono, presentan los compuestos saturados como los alcanos?
- Los alqueno y alquinos son compuestos insaturados. ¿Qué tipo de enlaces presentan estos compuestos?
- ¿Qué diferencia se puede establecer entre los compuestos saturados como los alcanos y los insaturados como alquenos y alquinos?
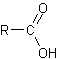
- Escriba los grupos funcionales para acido carboxílico , alcohol y aldehído
- Argumente el por qué el nombre de parafinas a los compuestos Alcanos.
- Observe las fórmulas de un compuesto alifático saturado y uno insaturado y escriba cuál es su diferencia
- ¿Qué es un grupo funcional? Escriba los grupos funcionales para:
Aromatico Aldehido Cetona Alcohol Amina - Escriba cuales son los grupos funcionales de los siguientes compuestos:
| Alcanos | . |
| Alquenos | . |
| Alquinos | . |
| alcoholes | . |
| Ácidos | . |
- ¿De dónde resulta un radical?
- Escriba en su cuaderno los siguientes radicales y de dónde provienen:
- Al metano CH4 se le quita un hidrógeno se forma el radical llamado metil CH3—
- Al etano C2H6 se le quita un hidrógeno y se forma el radical llamado etil C2H5—
- Al propano C3H8 se le quita un hidrogeno y se forma el radical llamado propil C3H7—
- Escriba los radicales del butano.
- Complete la siguiente tabla:
Nombre Fórmula condensada Radical Nombre Metano CH4 CH3— Metil Etano C2H6 . . Propano C3H8 . . Butano C4H10 . . Pentano C5H12 . .
También conocidos como hidrocarburos saturados es decir que poseen entre sus carbonos enlaces sencillos parafinas por ser poco reactivos químicamente
| Recordemos que el sufijo para los alcanos es ano (enlaces sencillos) y los primeros prefijos son: met = l carbono; et = 2 carbonos; prop = 3 carbonos; but = 4 carbonos. |
| Ahora siguiendo las reglas de la IUPAC de unir el prefijo y sufijo correspondiente, veamos algunos ejemplos de cómo nombrar los alcanos. |
| Fórmula semicondensada | Prefijo | Sufijo | Nombre del compuesto |
| CH4 | met | ano | metano |
| CH3 — CH3 | et | ano | etano |
| CH3 — CH2 — CH3 | prop | ano | propano |
| CH3 — CH2— CH2 — CH3 | but | ano | butano |
| CH3 — CH2 — CH2 — CH2 — CH3 | pent | ano | pentano |
Partiendo del nombre, también es muy fácil elaborar la fórmula del compuesto:
Ejemplo: construir la fórmula del hexano.

El hexano tiene 6 carbonos enlazados con enlaces sencillos.
Entonces, se dibujan los 6 carbonos,
C — C — C — C — C — C
se colocan 3 hidrógenos a los carbonos de los extremos
CH3 — C — C — C — C — CH3
y dos hidrógenos a cada carbono central.
CH3 — CH2 — CH2 — CH2 — CH2 — CH3
Taller de lectura 4:
- El siguiente cuadro muestra la forma como se pueden representar los alcanos con fórmula estructural. cuente los carbonos y los hidrógenos y deduzca la fórmula molecular o condensada, completando el cuadro.
Alcano Fórmula estructural Número de carbonos número de hidrógenos Fórmula condensada Metano 
1 4 CH4 Etano 
. . C2H6 Propano 
. . . Butano . . . . Pentano . . . . - Otra forma de representar los alcanos es con la fórmula semicondensada. Complete la siguiente tabla:
Alcano Fórmula estructural Fórmula semicondensada Fórmula molecular Metano . . . Etano . . . Propano . . . Butano . . . Pentano . . . - Escriba frente a cada prefijo el nñumero de carbonos
- Pent
- Hex
- Hept
- Oct
- Non
- Dec
- El número de hidrógenos es siempre el doble de carbonos más dos. Por tanto, la fórmula general de un alcano de cadena abierta es CnH2n+2. Escriba las fórmulas para los compuestos: hexano, heptano, octano nonano y decano.
- Escriba las fórmulas condensadas de los compuestos nonano y decano
Aplica las reglas de nomenclatura para los compuestos Alcanos vistos en clase. Escoge 10 ejercicios. No serán validos si son copia de otro trabajo.
1
3-ETIL-2,3DIMETILPENTANO
|
2
2-METILBUTANO
|
3
5-SEC-BUTIL-5-TERBUTILDECANO
| |||||
4
4-ETIL-2,2,5,6-TETRAMETILHEPTANO
|
5
5-TER-BUTIL-3-ETIL-5-ISOPROPILOCTANO
|
6
3-ETIL-4-ISOPROPIL-5-METILHEPETANO
| |||||
7
2,3-DIMETLBUTANO
|
8
4-ETIL-4-ISOBUTIL-7,7-DIMETILNONANO
|
9
2,3 DIETIL-2,4,5TRIMETIL-4-ISOBUTILNONANO
| |||||
10
3,3,DICLORO-2-NITRO- BUTANO
|
11
3-METIL-4-n-PROPILOCTANO
|
12
3,4,5,TRIBROMO-3-ETIL-2-ISOPROPILPENTANO
| |||||
13
3-BROMO-2-CLORO-2-METILPENTANO
|
14
3,4 DIETIL-4-TERBUTIL OCTANO
| 15
5,5-DIETIL-2-METIL-4-PROPIL-DECANO
| |||||
16
3-ETIL-6,7-DIMETIL-4-PROPILDECANO
|
17
3.5 DIETIL-2,3,4 TRIMETIL-DODECANO
|
18
2,3,5-TRIMETIL-OCTANO
| |||||
19
4-ETIL-4-METILHEPTANO
|
20
4-etil-2-metil-5-propiloctano
|
21
5-isopropil-3-metiloctano
| |||||
Propiedades físicas de los hidrocarburos Alcanos
Realizar las graficas correspondientes al punto de fusión, ebullición y densidad en papel milimetrado y hacer el siguiente análisis.
Observa, analiza y responda en el cuaderno:
1. Punto de fusión de los alcanos . A mayor peso molar, o peso molecular mayor punto de fusión.
Explica esta afirmación tomando como ejemplo dos puntos de referencia la gráfica de fusión
2. La Densidad Aumenta con el número de átomos de carbono .
Explica esta afirmación tomando como ejemplo dos puntos de referencia la gráfica de densidad.
3. Los alcanos son compuestos formados de C e H (Hidrocarburos) Son los más simples. Enlaces sencillos (saturados). Parafinas y cuya es Fórmula : CnH2n+2.
Con un ejemplo de la tabla y de las gráficas explica este concepto que describe detalladamente a los Alcanos.
4. Investiga cual es la fuente natural de los siguientes Alcanos metano, etano; propano y butano
5. Estado físico de los alcanos a temperatura ambiente Fórmula molecular Estado físico
CH4 a C4H10 gases
C5H12 a C17H36 líquidos
C18H38 y 16 posteriores. sólidos
Escribe la fórmula estructural de un alcano en estado solido, liquido , gaseoso y solido que se encuentre en las gráficas.
6. : Punto de ebullición. Los alcanos lineales tienen mayor punto de ebullición que los alcanos ramificados debido a que hay mayores fuerzas de van der Waals y de London, entre moléculas. Investiga en que consisten estas fuerzas intermoleculares y da un ejemplo para explicar este concepto.
7. Observa las gráficas de punto de fusión e Indica:
- El pico más alto y bajo en temperatura y a que compuestos pertenece.
- Escriba las fórmulas moleculares y estructurales correspondientes.
8. Observa las gráficas de punto de ebullición e Indica :
El pico mas alto y bajo en temperatura y a que compuestos pertenecen
Escriba las formulas moleculares y estructurales.
Escriba las formulas moleculares y estructurales.
9. Observa la gráfica de densidad e Indica :
- El pico mas alto y bajo en g/ml y a que compuestos pertenece.
- Escriba las formulas moleculares y estructurales correspondientes.
10. Escriba una conclusión sobre el comportamiento de las propiedades físicas de los alcanos analizadas en las gráficas .







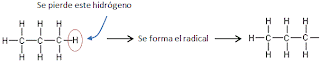



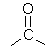


Comentarios
Publicar un comentario